研究者らは、パーキンソン病の脳内に有毒なタンパク質クラスターが発生するメカニズムを発見した。それは別の病気のために承認された薬で治療可能かもしれません。
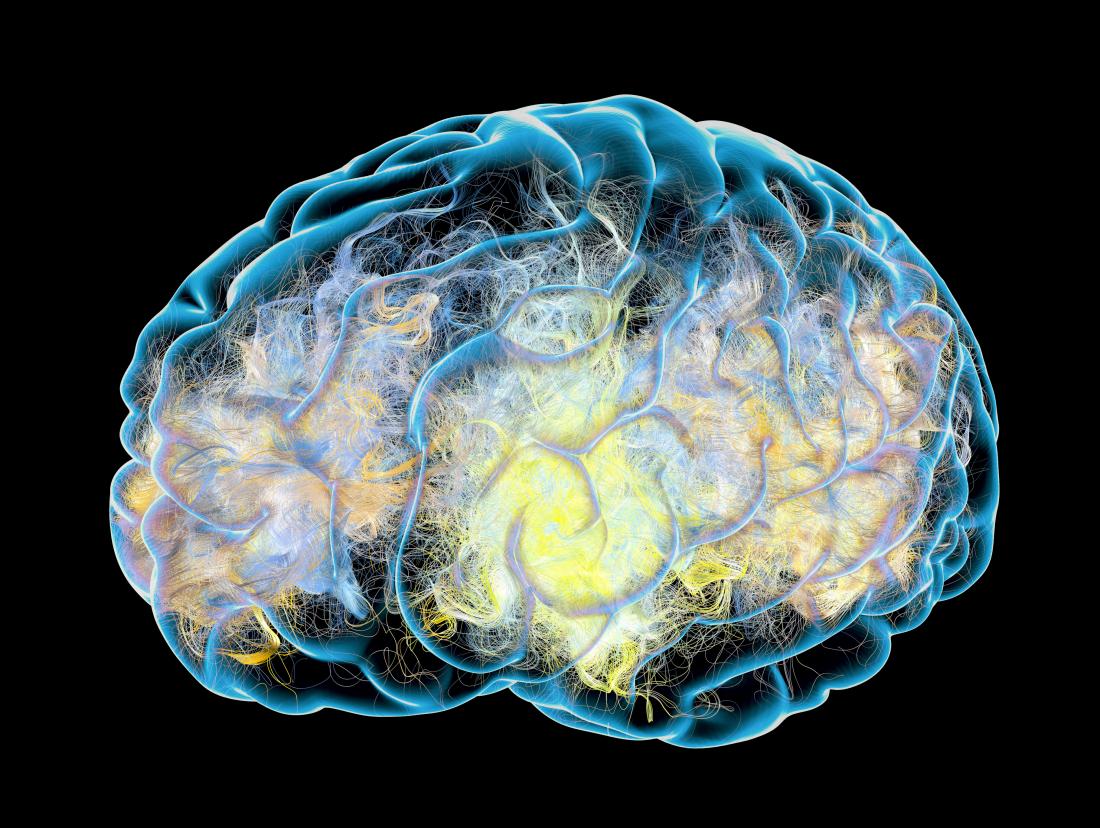
本誌に掲載された論文では、グルコシルセラミドと呼ばれる脂質や脂質の増加が、ドーパミン産生脳細胞内のα-シヌクレインタンパク質の毒性クラスターの蓄積を引き起こすことを発見した。
チームはまた、すでに承認されたグルコシルセラミドシンターゼ阻害剤(脂質の生成を減少させる薬物)による治療が、パーキンソン病の特徴である毒性タンパク質クラスターを減少させることを明らかにした。
シニアのノースウェスタン大学フェインバーグ医科大学の助教授であるジョセフ・マズッリ(Joseph Mazzulli)教授は、「一部の企業は、脂質の合成を減らすためにシンターゼ阻害剤を使用しており、我々の研究では患者由来のニューロンを使用した。
「我々は、パーキンソン病患者由来のニューロン内で、毒性α-シヌクレイン凝集を直接減少させることができた」と付け加えた。
パーキンソン病はドーパミン細胞死から生じる
パーキンソン病は、黒質(substantia nigra)として知られる脳領域内の細胞の死から生じる進行性の状態である。細胞はドーパミンと呼ばれる化学的メッセンジャーを生成し、これは運動の調節に重要である。
パーキンソン病の主な症状は、振戦、運動の遅れ、および硬直、ならびにバランスおよび協調の減少である。他の症状には、情動的変化、睡眠障害、うつ病、発言困難、嚥下および咀嚼の問題、および便秘が含まれる。
パーキンソン氏は、50歳未満の患者では少数の症例が診断されますが、60歳後にはほとんどが殴打されます。症状が悪化するにつれて、日々の課題に対処して独立生活をリードすることが難しくなります。
世界中でパーキンソン病に罹患している人口は1000万人を超え、米国では約1万人(毎年約60,000人の症例が単独で診断されています)があります。
パーキンソン病の治療法はまだありませんが、多くの患者さんに症状緩和剤を提供しています。
GBA1変異およびパーキンソン病
研究論文では、Mazzulli教授とチームは、パーキンソン病における毒性α-シヌクレインクラスターの発症のリスク因子がグルコセレブロシダーゼ(GBA1)遺伝子の変異であると説明しています。
この遺伝子は、リソソームの正確な機能にとって重要なタンパク質を産生する。このタンパク質は、グルコシルセラミドおよび他の脂質を分解および除去する細胞内の区画である。
GBA1の1つの突然変異コピーを有するものは、グルコシルセラミドの正常レベルより高いレベルを有し、パーキンソン病を発症するリスクがより高い。
遺伝子の2つの突然変異コピー(各親からの1つ)を有することにより、ゴーシェ病に至ることがあり、これはリソソームが破壊され、脂肪化合物が体内に蓄積する稀な疾患である。
しかしながら、GBA1変異は、おそらくはグルコシルセラミドクリアランスの破壊を介して、有毒なα-シヌクレインクラスターの発達に結びついていることは知られているが、新しい研究までは明確ではない。
突然変異したGBA1は必要ないかもしれない
調べるために、科学者は、患者由来の幹細胞から成長したドーパミン産生ニューロンにおけるグルコシルセラミドのレベルを上昇させる薬物の効果を試験した。細胞はGBA1遺伝子の変異型を有していなかった。
彼らは、突然変異した遺伝子がなくても、ニューロンに有毒なα-シヌクレインクラスターが蓄積していることを発見しました。
Mazzulli教授は、正常α-シヌクレインのその毒性形態への変換は、必ずしも「突然変異したGBA1タンパク質の存在によるものではなく、より重要なことに、グルコシルセラミドの活性および蓄積の減少」に依存することを示唆している。
複雑なα-シヌクレインおよび毒性クラスター
α-シヌクレインの正常な形態から毒性の形態への変換を詳しく調べると、以前考えられていた単純な形態のα-シヌクレインだけが毒性クラスターに変換されたのではないことが発見されました。
代わりに、グルコシルセラミドは、α-シヌクレインの複合体を毒性クラスターに直接変換していました。 「大きなαシヌクレイン複合体の直接的な変換によって毒性凝集が起こることに驚いた」とMazzulli教授は説明する。
“我々は、複合体が毒性凝集体を形成する前に最初に分解しなければならないと考えていたが、それは我々のデータが示すものではない」と彼は続けた。
彼は、ゴーシェ病の治療のために考案された薬物は、このメカニズムを標的とする一つの方法かもしれないと述べている。
これらの知見はまた、薬物が試行においてどれほどうまくいくかを測定する方法を提供する。パーキンソン病の治療の目標はα-シヌクレインのクラスターを減らすことですが、生存患者の毒性タンパク質のレベルを測定することは容易ではありません。
「脂質は、血液や脳脊髄液などの容易に入手できる液体から直接測定できるため、患者のグルコシルセラミドを変える治療法の効果を測定する方がはるかに簡単です。
ジョセフ・マズッリ教授